Kinh doanh & pháp luật, Sức khỏe, Sức khỏe cộng đồng, Thông tin
Triệt phá đường dây sản xuất thuốc giả quy mô lớn hàng trăm tỉ đồng
Triệt phá đường dây sản xuất thuốc giả quy mô lớn hàng trăm tỉ đồng
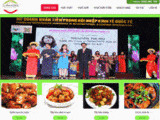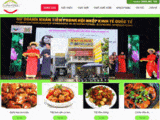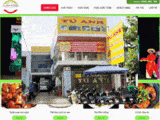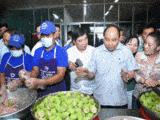
(VietQ.vn) – Phòng Cảnh sát kinh tế – Công an tỉnh Thanh Hoá vừa triệt phá đường dây sản xuất, buôn bán thuốc tân dược giả với quy mô lớn trên phạm vi toàn quốc, bắt giữ 14 đối tượng về tội “sản xuất, buôn bán hàng giả là thuốc phòng bệnh, thuốc chữa bệnh”.
Qua công tác nắm tình hình trên không gian mạng, Phòng Cảnh sát kinh tế phát hiện trên địa bàn TP.Thanh Hóa và một số địa phương khác có một nhóm đối tượng có dấu hiệu nghi vấn sản xuất, buôn bán hàng giả là thuốc chữa bệnh, thuốc phòng bệnh với nhiều thủ đoạn hết sức tinh vi nên đã lập chuyên án đấu tranh.
Chỉ trong thời gian ngắn, Phòng Cảnh sát kinh tế đã thu thập đầy đủ tài liệu, chứng cứ, đồng thời huy động lực lượng phối hợp khám xét khẩn cấp 6 địa điểm là nơi sản xuất, nơi làm việc, nơi cất giấu hàng hóa của các đối tượng trên địa bàn TP.Hà Nội, TP.HCM và các tỉnh Vĩnh Phúc, Hưng Yên, An Giang, Đồng Tháp.

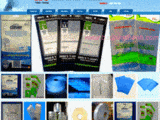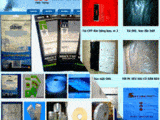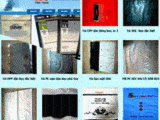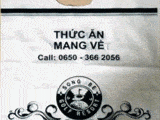
Qua khám xét, lực lượng công an thu giữ 21 loại thuốc tân dược, thuốc chữa xương khớp giả gồm: 44 hộp thuốc Tetracyclin, 40 hộp thuốc Clorocid, 49 hộp thuốc Pharcoter, 52 hộp thuốc Neo-Codion; 1232 hộp nhức khớp tê bại hoàn; 4122 hộp Tui Hua Shen Jing Tong (thường gọi là thuốc thoái hóa Sigapore); 2285 hộp Trùng thảo sâm nhung bổ tỳ khai vị đại bổ hoàn; 1923 hộp Profeessor’s Pill (thường gọi là khớp xanh); 5172 hộp Mujarhabat Kapsul (thường gọi là khớp xanh); 2017 hộp thuốc Gai cốt hoàn; 930 hộp thuốc Tọa cốt thiên ma thống phong hoàn; 6612 hộp thuốc Tuyết liên thiên ma bảo khớp hoàn; 1014 hộp thuốc Phong tê nhức Bạch Xà Vương; 4743 hộp thuốc Phong tê nhức Hổ Cốt Hoàn…
Ngoài ra, công an còn thu giữ hơn 18.000 vỏ hộp các loại, 142 kg các loại viên hoàn, viên nén, bột và nhiều máy móc, thiết bị phục vụ hoạt động sản xuất thuốc giả; dây chuyền sản xuất, máy ép, khuôn ép vỉ, băng keo dán và hàng ngàn sản phẩm hàng hóa là thuốc chữa bệnh khác chưa xuất trình được hóa đơn, chứng từ chứng minh nguồn gốc xuất xứ. Tổng khối lượng thuốc tân dược giả và nguyên liệu làm thuốc tân dược giả thu giữ là gần 10 tấn.
Theo Công an tỉnh Thanh Hóa, cầm đầu đường dây này là Nguyễn Tiến Đạt (SN 1991; ngụ chung cư Hapulico, quận Thanh Xuân, Hà Nội). Đạt đã câu kết với nhóm của Trịnh Doãn Giáo (SN 1985; ngụ quận Bình Tân, TP.HCM) là đối tượng cầm đầu đường dây sản xuất, buôn bán hàng giả là thuốc chữa bệnh, xương khớp đã đầu tư dây chuyền, máy móc sản xuất và nghiên cứu các thành phần của thuốc tân dược. Sau đó, chúng đặt mua các nguyên liệu là dược phẩm, dược liệu, thảo mộc không rõ nguồn gốc, xuất xứ, thuê nhân công trộn lẫn nghiền thành bột, sử dụng máy móc đóng thành viên nang, ép vỉ, đóng gói thành phẩm bán ra thị trường qua các kênh phân phối.
Kể từ năm 2021 đến khi bị bắt, đường dây này đã bán ra thị trường số lượng thuốc giả rất lớn, số tiền thu lời bất chính ước tính gần 200 tỉ đồng.
Hiện, vụ án đang được Công an tỉnh Thanh Hóa mở rộng điều tra, làm rõ.
Theo Tổ chức Y tế Thế giới (WHO), thuốc giả là sản phẩm được sản xuất với ý đồ lừa đảo, gồm các trường hợp sau: hoàn toàn không có dược chất được ghi trên nhãn thuốc; có dược chất nhưng hàm lượng ít hơn, thậm chí rất ít so với hàm lượng ghi trên nhãn; có dược chất nhưng dược chất hoàn toàn khác so với dược chất ghi trên nhãn, thậm chí có thuốc giả trong đó dược chất là độc chất gây chết người; có dược chất ghi đúng trên nhãn, có bao bì, quy cách đóng gói, tên thuốc giống như thuốc của chính hãng được quyền sở hữu công nghiệp nhưng do một hãng làm giả sản xuất.
Thuốc giả gây tác hại ở 2 phương diện. Thuốc giả gây thiệt hại rất trầm trọng đến uy tín các hãng dược phẩm nổi tiếng làm ăn chân chính. Thuốc bị làm giả người dùng thuốc không phân biệt được đâu là thật hay giả do thuốc giả dùng tên thuốc, nhãn hiệu, thương hiệu, bao bì được làm giả giống y như thuốc thật.
Thuốc giả gây tác hại cho chính người dùng thuốc. Nếu thuốc giả không chứa dược chất hoặc chứa dược chất nhưng không đủ hàm lượng, người bệnh dùng sẽ không chữa được bệnh, làm bệnh nặng thêm và có thể dẫn đến tử vong. Nhưng nguy hiểm hơn có loại thuốc giả chứa độc chất nguy hiểm, người bệnh dùng bị tai biến (như trường hợp thuốc giả mạo là đông dược trộn thuốc corticoid gây các tai biến trầm trọng), hoặc gây chết người.
Thông tư số 06/VBHN-BYT quy định về tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc
Thông tư này quy định việc áp dụng tiêu chuẩn chất lượng thuốc (thuốc hóa dược, thuốc dược liệu, vắc xin, sinh phẩm), nguyên liệu làm thuốc (bao gồm cả bán thành phẩm, bán thành phẩm dược liệu, trừ dược liệu); việc kiểm nghiệm thuốc, nguyên liệu làm thuốc và thủ tục thu hồi, xử lý thuốc vi phạm.
Về việc áp dụng tiêu chuẩn chất lượng thuốc, Thông tư quy định các cơ sở kinh doanh dược, cơ sở pha chế thuốc áp dụng tiêu chuẩn chất lượng của thuốc, nguyên liệu làm thuốc theo dược điển hoặc tiêu chuẩn cơ sở đối với thuốc, nguyên liệu làm thuốc do cơ sở sản xuất, pha chế.
Cơ sở kinh doanh dược, cơ sở pha chế thuốc phải tiến hành thẩm định, đánh giá phương pháp kiểm nghiệm ghi trong tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc do cơ sở sản xuất công bố áp dụng. Việc thẩm định phương pháp kiểm nghiệm thực hiện theo hướng dẫn về thẩm định quy trình phân tích của Hiệp hội các nước Đông Nam Á hoặc ICH được quy định tại Thông tư quy định việc đăng ký thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành.
Bộ Y tế tổ chức thẩm định hồ sơ và phê duyệt tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc theo quy định về đăng ký thuốc, nguyên liệu làm thuốc, quy định về cấp phép nhập khẩu thuốc, nguyên liệu thuốc chưa có giấy đăng ký lưu hành.
Tại Điều 4 quy định về việc áp dụng dược điển: Cơ sở kinh doanh dược, cơ sở pha chế thuốc được áp dụng Dược điển Việt Nam hoặc một trong các dược điển tham chiếu sau đây: Dược điển Châu Âu, Anh, Hoa Kỳ, Quốc tế, Nhật Bản.
Việc áp dụng tiêu chuẩn trong các dược điển quy định phải bao gồm toàn bộ quy định về chỉ tiêu chất lượng, mức chất lượng và phương pháp kiểm nghiệm quy định tại chuyên luận thuốc, nguyên liệu làm thuốc tương ứng của dược điển áp dụng; bao gồm cả quy định về chỉ tiêu chất lượng, mức chất lượng và phương pháp kiểm nghiệm chung được quy định tại Phụ lục của dược điển.
Trường hợp cơ sở sản xuất công bố áp dụng một trong các dược điển quy định nhưng sử dụng phương pháp kiểm nghiệm khác với phương pháp kiểm nghiệm được ghi trong chuyên luận riêng của thuốc, nguyên liệu làm thuốc trong dược điển đã chọn thì phải chứng minh sự tương đương giữa phương pháp kiểm nghiệm của nhà sản xuất với phương pháp kiểm nghiệm được ghi trong dược điển. Kết quả kiểm nghiệm sử dụng phương pháp kiểm nghiệm ghi trong dược điển là căn cứ để kết luận chất lượng thuốc. Đối với thuốc dược liệu, cơ sở kinh doanh dược, cơ sở pha chế thuốc được áp dụng dược điển quy định hoặc dược điển nước xuất xứ của thuốc.
Tại Điều 5 của Thông tư cũng quy định việc áp dụng tiêu chuẩn cơ sở: Tiêu chuẩn cơ sở về thuốc, nguyên liệu làm thuốc phải đáp ứng quy định tại điểm b Khoản 2 Điều 102 của Luật dược, cụ thể như sau: Đáp ứng yêu cầu về chỉ tiêu chất lượng, mức chất lượng được quy định tại chuyên luận tương ứng của dược điển Việt Nam và chỉ tiêu chất lượng, mức chất lượng, phương pháp kiểm nghiệm chung được quy định tại các phụ lục của dược điển Việt Nam;
Trường hợp dược điển Việt Nam, dược điển tham chiếu quy định tại Điều 4 Thông tư này chưa có chuyên luận thuốc, nguyên liệu làm thuốc tương ứng. Cơ sở xây dựng tiêu chuẩn trên cơ sở kết quả nghiên cứu khoa học (bao gồm cả kết quả nghiên cứu phát triển sản phẩm) hoặc theo quy định của dược điển nước ngoài khác. Tiêu chuẩn cơ sở của thuốc pha chế, bào chế tại cơ sở khám bệnh, chữa bệnh do cơ sở xây dựng, đánh giá sự phù hợp và được người đứng đầu cơ sở ban hành.
Tại Điều 6 quy định về việc cập nhật tiêu chuẩn chất lượng và áp dụng dược điển cập nhật: đối với thuốc, nguyên liệu làm thuốc đăng ký lưu hành, đăng ký gia hạn. Tại thời điểm nộp hồ sơ đăng ký, tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc phải đáp ứng dược điển thuộc một trong hai trường hợp sau đây: Dược điển phiên bản hiện hành; Các dược điển phiên bản trước phiên bản hiện hành, nhưng không quá 02 năm tính đến thời điểm dược điển phiên bản hiện hành có hiệu lực.
Đối với thuốc, nguyên liệu làm thuốc đã được cấp phép lưu hành: Trong thời hạn tối đa 02 năm kể từ thời điểm phiên bản dược điển mới nhất được ban hành, cơ sở đăng ký, cơ sở sản xuất có trách nhiệm cập nhật tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc theo quy định tại phiên bản dược điển đó.
Trong quá trình lưu hành thuốc, nguyên liệu làm thuốc, cơ sở sản xuất, cơ sở đăng ký phát hiện yếu tố có ảnh hưởng nghiêm trọng đến chất lượng, an toàn, hiệu quả của thuốc hoặc theo yêu cầu của Bộ Y tế. Cơ sở sản xuất phải tiến hành cập nhật chỉ tiêu vào tiêu chuẩn chất lượng thuốc, nguyên liệu làm thuốc để kiểm soát được yếu tố ảnh hưởng trên.
An Nguyên
| Nguồn: https://vietq.vn/triet-pha-duong-day-san-xuat-thuoc-gia-hang-tram-ti-dong-tai-thanh-hoa-d232430.html |